Соль - одно из наиболее распространенных веществ, используемых в пищевой промышленности и в нашей повседневной жизни. Узнать, почему соль не растворяется до конца, может показаться странным, ведь мы привыкли к тому, что соль растворяется в воде без остатка.
Однако, не все так просто. Когда мы кладем пищевую соль в воду и перемешиваем ее, соль действительно растворяется, и мы видим прозрачное растворение. Но если провести эксперимент и дать этому раствору постоять, то вскоре мы увидим, что на дне остается небольшое количество нерастворившейся соли.
Почему же это происходит? Все дело в насыщенном растворе. На всемирно известном уроке химии в школе мы уже учились, что растворение вещества зависит от его растворимости в определенной среде. И соль здесь - не исключение.
Соль является ионным соединением, состоящим из катиона и аниона. Когда соль попадает в воду, между молекулами воды и ионами соли возникают силы притяжения, которые заставляют ионы растворяться. Однако, с ростом концентрации соли в воде, насыщение раствора наступает, и вся соль перестает растворяться до конца.
Состав и свойства соли
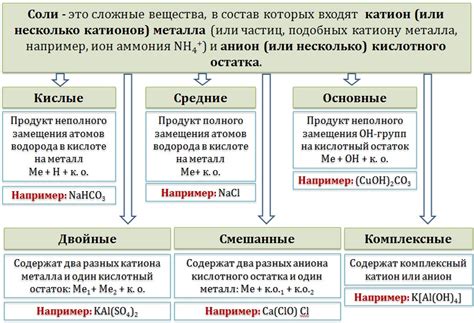
Соль имеет сильный электролитический характер и способна образовывать ионы в водных растворах. При контакте с водой соль начинает растворяться, при этом происходит разделение ионов натрия и хлора.
Однако не вся соль полностью растворяется в воде. Некоторые ионы остаются нерастворимыми и образуют осадок. Это происходит из-за достижения предельной растворимости соли - максимального количества соли, которое может быть растворено при определенной температуре.
Соль также обладает хорошей растворимостью в воде благодаря полярности молекулы воды. Полярные молекулы образуют водородные связи с ионами соли, что способствует их распаду и растворению.
Использование соли широко разнообразно: она применяется в пищевой промышленности как приправа, используется в медицине, промышленности и в процессе замораживания пищевых продуктов, где соль играет роль антифриза и помогает сохранить качество и вкус продукта.
Растворение соли

При растворении соли вода сначала взаимодействует с поверхностью частиц соли и образует агрегаты с молекулами соли. Затем вода начинает проникать внутрь этих агрегатов и взаимодействует с молекулами соли. Когда водные молекулы входят в контакт с молекулами соли, происходит процесс диссоциации, при котором молекулы соли разделяются на положительно и отрицательно заряженные ионы.
Однако растворение соли может быть ограничено несколькими факторами. Во-первых, температура воды играет важную роль в процессе растворения соли. При повышении температуры скорость движения молекул воды увеличивается, что способствует более активному взаимодействию молекул соли с водными молекулами и повышению растворимости соли.
Во-вторых, концентрация соли в растворе может сказываться на его растворимости. Если концентрация соли высока, возможно достижение насыщения раствора, когда больше соли не может быть растворено. В этом случае остаток соли остается нерастворенным.
Также влияние на растворимость соли оказывает ее химическая природа, внешняя среда и другие факторы. Некоторые соли более растворимы, чем другие, например, сахариды или натрия хлорид.
- В целом, растворение соли – сложный процесс, который зависит от множества факторов. Несмотря на то, что соль считается растворимым веществом, она не всегда растворяется без остатка в воде. Знание этих факторов помогает понять и объяснить, почему соль не растворяется до конца.
Растворимость соли
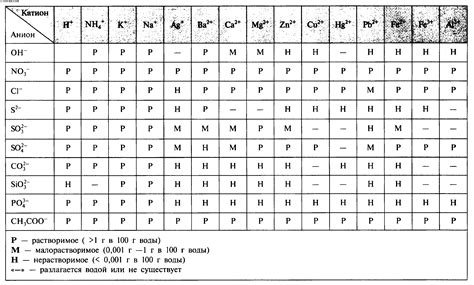
Растворимость соли - это способность соли или ее ионов растворяться в растворителе. Большинство солей, таких как хлорид натрия (NaCl) или сульфат магния (MgSO4), обладают достаточно высокой растворимостью и полностью растворяются в воде. Однако существуют соли, для которых растворимость намного ниже.
При растворении соли в воде, происходит процесс диссоциации, в результате которого образуются ионы соли. Вода является полярным растворителем, а ионы соли также являются полярными, поэтому они взаимодействуют друг с другом и растворяются. Однако процесс растворения не всегда протекает полностью, и часть соли остается нерастворенной.
Различные факторы могут оказывать влияние на растворимость соли. Одним из наиболее важных факторов является температура растворителя. В общем случае, с увеличением температуры растворимость соли увеличивается, поскольку это способствует лучшему разрушению взаимодействий между ионами соли и силами притяжения между молекулами растворителя. Однако есть и такие соли, растворимость которых с увеличением температуры уменьшается, такие явления обычно связаны с изменением химического равновесия в растворе.
Кроме того, другие факторы, такие как давление, размеры ионов, наличие других растворенных веществ и так далее, также могут оказывать влияние на растворимость соли. Например, добавление другой соли может снизить растворимость соли.
Таким образом, растворимость соли - это сложный процесс, зависящий от различных факторов. Понимание этих факторов поможет лучше понять, почему некоторые соли не растворяются полностью и как можно изменить условия растворения солей, если это необходимо.
Закон-соотношение растворимости

Согласно закону, при определенной температуре существует предельная концентрация вещества, которую можно растворить в данном растворителе. Эта концентрация называется растворимостью.
Закон-соотношение растворимости утверждает, что растворимость твердого вещества в жидкости зависит от температуры и химической природы вещества. При повышении температуры обычно увеличивается растворимость, а при понижении - уменьшается.
Но почему не все вещества полностью растворяются? Одной из причин является насыщение растворителя. Когда насыщение достигается, растворитель больше не может растворять дополнительное вещество и оно переходит в свою первоначальную твердую форму.
Кроме того, некоторые вещества образуют стабильные кристаллические структуры, которые не могут разрушиться в процессе растворения. Поэтому даже при достижении насыщения, некоторая часть вещества останется нерастворенной.
Также, часть вещества может просто не диссоциировать в ионные формы и оставаться в молекулярном состоянии, что делает его менее растворимым.
Закон-соотношение растворимости является важным физико-химическим принципом, позволяющим предсказать растворимость вещества в определенных условиях. Это знание имеет практическое применение в различных областях, включая фармацевтику, пищевую промышленность и экологию.
Влияние температуры на растворимость соли
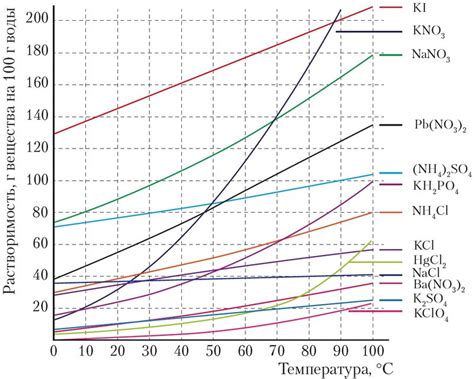
Вещества имеют различную энергию и активность при разных температурах. При повышении температуры, частицы вещества получают больше энергии, начинают двигаться быстрее, что приводит к возрастанию частоты столкновений и расширению пространства между частицами. В результате, сила притяжения частиц соли с растворителем ослабевает, что способствует лучшей растворимости соли.
Однако, в некоторых случаях, растворимость соли может увеличиваться при понижении температуры. Это связано с образованием гидратирующей воды оболочки вокруг ионов соли. При низких температурах, структура водной оболочки становится более устойчивой, что создает условия для большего числа молекул растворителя с положительным зарядом (в случае катионов) и отрицательным зарядом (в случае анионов). Это приводит к увеличению растворимости соли.
Для наглядного представления влияния температуры на растворимость соли можно использовать таблицу, в которой будут указаны конкретные значения растворимости при разных температурах.
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 35.7 |
| 20 | 36.0 |
| 40 | 36.4 |
| 60 | 37.0 |
| 80 | 38.3 |
Рассмотренный пример показывает, что с ростом температуры растворимость соли увеличивается.
Влияние поверхности соли на растворимость
Молекулы поверхности соли имеют открытые и активные участки, которые могут вступать во взаимодействие с молекулами растворителя, в данном случае – воды. Чем больше поверхность соли, тем больше активных участков доступно для взаимодействия с водой, что способствует более быстрому растворению.
Однако, даже при наличии большой поверхности соли, полное растворение может не происходить. Это связано с ограниченной растворимостью соли при определенных условиях. Когда насыщенный раствор достигает определенной концентрации, дальнейшее добавление соли приводит к образованию нерастворимых осадков.
Чтобы увеличить поверхность соли и ускорить растворение, можно использовать различные методы обработки соли перед ее добавлением в растворитель. Например, соль можно помолоть до мелкого порошка, что увеличит общую поверхность и улучшит взаимодействие с водой. Также можно использовать химические методы обработки, которые помогут увеличить активность поверхности соли.
| Преимущества большой поверхности соли: | Методы увеличения поверхности соли: |
|---|---|
| 1. Быстрое растворение | 1. Помол |
| 2. Большая степень растворимости | 2. Химическая обработка |
| 3. Улучшенное взаимодействие с молекулами растворителя |
Влияние поверхности соли на растворимость подчеркивает важность обработки соли перед ее добавлением в растворитель. Различные методы могут быть использованы для увеличения поверхности и улучшения процесса растворения.
Субрастворимость и осадки
Когда соль растворяется в воде, ее молекулы разбиваются на ионы - положительно заряженные катионы и отрицательно заряженные анионы. Если рассмотреть раствор соли под микроскопом, то можно увидеть, что некоторые из этих ионов может начать связываться друг с другом и образовывать несколько агрегатов.
Эти агрегаты, или кластеры, являются осадками. Они представляют собой маленькие частицы соли, которые не растворяются полностью в растворе. Обычно осадки образуются из-за низкой субрастворимости соли в данной среде или из-за превышения ее концентрации в растворе.
Таким образом, субрастворимость соли является основной причиной образования осадков. Это явление может также быть вызвано изменением условий растворения, таких как температура, pH и наличие других веществ в растворе.
Осадки имеют различные формы и размеры и могут накапливаться на дне емкости. Они могут быть очевидными в виде белых или цветных кристаллических отложений, или же не видны невооруженным глазом и образовывать тонкий слой на поверхности раствора.
Субрастворимость и образование осадков являются важными понятиями в химии и имеют множество практических применений, особенно в области техники и науки о материалах.
| Примеры субрастворимости и осадков: |
|---|
| Для раствора карбоната кальция (известного как известь) существует предел растворимости, после которого начинают образовываться осадки в виде белого кристаллического порошка. |
| Растворение сульфата свинца может привести к образованию ядовитых осадков, которые могут находиться в виде тяжелых металлических соединений или пыли. |
| Осадки могут образовываться в трубопроводах и других системах, если концентрация растворенной соли превышает предельно допустимую норму, что может привести к чрезмерному накоплению отложений и нарушению работы системы. |



