Медь – это металлический химический элемент, который обладает яркой красной окраской и хорошей теплопроводностью. Она является одним из самых популярных и востребованных металлов в мире. Издревле медь использовалась в производстве различных изделий, от украшений и знаков наличия до проводов и монет. Но национальным достоянием многих стран считается давно прекращенная производственная деятельность связанная с медью.
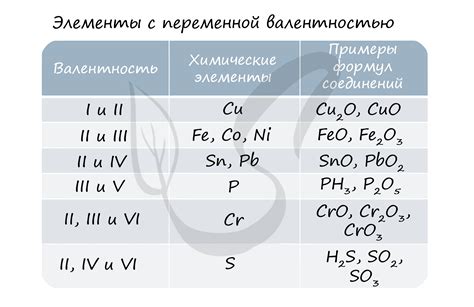
Важным характером любого элемента в химии является его валентность. Валентность показывает способность атома элемента присоединяться к другим атомам. Валентность меди не является постоянной величиной, и она может изменяться в зависимости от сценария. Медь способна проявлять разные валентности: 1 валентность (Cu+), 2 валентность (Cu2+), но наиболее распространена 2 валентность.
Почему медь обладает такой валентностью? Ответ на этот вопрос можно найти в электронной конфигурации меди. Атом меди имеет 29 электронов, распределенных по энергетическим оболочкам. Внешним слоем в атоме меди находятся два электрона, а это именно та часть электронов, которая участвует в химических реакциях. В процессе реакции с другими элементами, медь желает либо отдать 1 электрон и принять 1 электрон для приобретения 1 валентности, либо отдать 2 электрона для приобретения 2 валентности.
Теперь, когда вы знаете о валентности меди, вы можете лучше понять ее характеристики и применение в различных областях, включая химию, электронику, электрику и многие другие. Медь, с ее способностью проявлять различные валентности, является важным элементом в химической промышленности и играет важную роль в различных процессах и технологиях.
Какая валентность у меди и почему
Валентность 1 является более распространенной у меди и означает, что атом меди способен отдавать один электрон. Это связано с наличием внешней электронной оболочки с одним электроном в s-орбитали. Медь с валентностью 1 часто встречается в природе и используется в различных процессах, таких как химические реакции и электролиз.
Однако, медь также может образовывать соединения с валентностью 2, где атом меди способен отдавать два электрона. Для этого меди требуется использовать d-орбиталь, что связано с особенностями ее электронной структуры. Медь с валентностью 2 обычно встречается в соединениях с непереходными металлами, такими как кислород, сера и галогены.
Таким образом, валентность меди зависит от ее электронной структуры и способности атома меди отдавать электроны. Возможность меди образовывать различные валентности делает ее важным элементом в химических процессах и различных применениях, включая электротехнику, металлургию и каталитические реакции.
Валентность меди: определение и значение

Медь имеет несколько возможных валентностей, включая +1 и +2. Однако наиболее типичной является валентность +2, которая характерна для соединений меди с большинством других элементов. В соединениях с валентностью +2, медь отдает два электрона. Это делает медь атомом с положительным зарядом, что позволяет ей образовывать связи с атомами, обладающими отрицательным зарядом, такими как кислород, сера и хлор.
Однако медь также может образовывать соединения с валентностью +1. В этих соединениях медь отдает один электрон, что делает ее атомом с положительным зарядом +1. Такие соединения меди часто встречаются в природе, например, в минералах и рудах.
Знание валентности меди важно для понимания ее химических свойств и используется при синтезе и изучении соединений меди. Валентность меди также имеет большое значение в промышленности, особенно в производстве электрических и магнитных материалов, таких как провода, кабели и магнитные сплавы. Благодаря своей способности образовывать разнообразные соединения, медь нашла широкое применение в различных отраслях науки и промышленности.
Какая валентность у меди и почему она может изменяться?

Валентность - это количество электронов, которые атом может отдать или принять во время химической реакции. Для меди валентность может изменяться в зависимости от условий.
Обычно медь имеет две основные валентности - 1 и 2. Валентность 1 обозначается как Cu(I), а валентность 2 - как Cu(II). Это означает, что медь может отдать один или два электрона при взаимодействии с другими элементами.
Изменение валентности меди может происходить в химических реакциях или в различных окружающих условиях, таких как окисление или взаимодействие с разными кислотами и основаниями. Например, при окислении меди из Cu(I) в Cu(II), она принимает еще один электрон, что повышает ее валентность.
Важно отметить, что валентность меди может варьироваться в различных соединениях и соединительных группах. Например, медный ион в хлориде меди (CuCl) имеет валентность 1, тогда как медный ион в сернокислом меди (CuSO4) имеет валентность 2.
Эта способность меди менять свою валентность делает ее чрезвычайно полезным элементом в различных химических и физических процессах. Благодаря этому свойству медь может участвовать во многих реакциях и обладает широким спектром применений в разных отраслях.
Роль валентности меди в химических реакциях

Валентность меди влияет на ее способность образовывать различные соединения и проявлять определенные химические и физические свойства. Например, медный ион с валентностью 1 (Cu+) имеет свойство окисляться при взаимодействии с веществами, содержащими валентность 2. Это свойство меди с валентностью 1 используется во многих электрохимических процессах, включая гальванические элементы и коррозию металлов.
Валентность меди также играет важную роль в процессах формирования соединений с другими элементами, таких как кислород, сера, серебро и многие другие. Например, медь с валентностью 2 может образовывать стабильные соединения с кислородом и серой, такие как оксид меди (CuO) и сульфид меди (CuS).
Каждая валентность меди имеет свои свойства и характеристики, которые могут быть использованы в различных химических реакциях. Например, медь с валентностью 3 обладает способностью образовывать стабильные комплексные соединения с определенными органическими соединениями, что находит применение в катализаторах и органическом синтезе.
Таким образом, валентность меди играет ключевую роль в ее химических свойствах и влияет на ее поведение в различных химических реакциях. Понимание валентности меди позволяет улучшить производство соединений и материалов на основе меди, а также применение меди в различных областях, включая энергетику, медицину и электронику.
Влияние валентности меди на свойства и применение
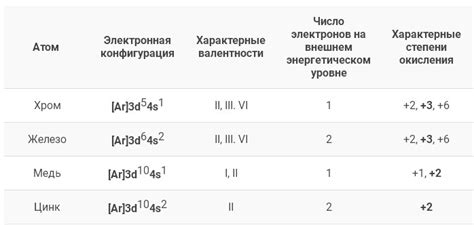
Медь имеет несколько валентностей, самой распространенной является двухвалентная валентность (Cu2+). Также возможна одновалентная валентность (Cu+), трехвалентная валентность (Cu3+) и даже четырехвалентная валентность (Cu4+), но они встречаются гораздо реже.
Валентность меди оказывает значительное влияние на ее физические и химические свойства, а также на ее применение в различных областях.
Одной из основных особенностей двухвалентной меди является ее способность к катализу. Каталитические свойства двухвалентной меди позволяют ей принимать участие во многих химических реакциях. Она активно используется, например, в промышленности для производства пластмасс, удобрений и фармацевтических препаратов.
Медь с одновалентной валентностью также обладает каталитическими свойствами, однако она менее распространена в природе и встречается преимущественно в некоторых органических соединениях.
Трехвалентная и четырехвалентная медь реже встречаются и имеют более специфические свойства. Они обычно используются в электронике, например, в качестве материалов для создания суперпроводников и полупроводниковых приборов.
Кроме химических свойств, валентность меди может также влиять на ее физические свойства, такие как плотность, теплопроводность и электропроводность. Медь с разными валентностями может иметь различную плотность и электропроводность, что определяет ее применение в различных областях, включая проводники и электронные устройства.
Таким образом, валентность меди играет ключевую роль в определении ее свойств и применении. Понимание влияния валентности позволяет эффективно использовать медь в различных областях, от промышленности до электроники.



