Сернистый газ, или диоксид серы (SO2), известен своим резким запахом и способностью вызывать раздражение слизистых оболочек. Его электронная формула, которая отражает распределение электронных пар внутри молекулы, объясняет, почему она имеет нелинейную структуру.
Молекула сернистого газа состоит из одного атома серы (S) и двух атомов кислорода (O). Эти атомы связаны между собой с помощью двойных ковалентных связей, что создает уникальную геометрию молекулы.
Согласно электронной формуле SO2, атом серы образует две σ-связи с атомами кислорода, атрибутируемые как две электронные пары, и одну π-связь, которая не учитывается в электронной формуле. Это положение электронных пар приводит к образованию углов, отличных от 180 градусов вокруг атома серы, делая молекулу нелинейной.
Электронная формула сернистого газа
Сернистый газ (SO2) представляет собой химическое соединение серы и кислорода. Его электронная формула позволяет понять строение молекулы и определить причины нелинейности.
Электронная формула SO2 состоит из атома серы (S) и двух атомов кислорода (O), соединенных двойными ковалентными связями. Атом серы обладает 16 электронами, включая 6 валентных электронов, и его электронная конфигурация обозначается как [Ne] 3s2 3p4.
Каждый атом кислорода имеет 8 электронов. Чтобы достигнуть октетной стабильности, сера образует две одинарные ковалентные связи с кислородом, делая общее количество электронов в околоядерной области 18.
Электронная формула SO2 подразумевает, что атом серы находится в центре молекулы, окруженный двумя атомами кислорода, образующими угол между собой. Это является причиной нелинейности молекулы SO2.
Углеродатом сернистого газа является атом серы, а кислородные атомы - электроотрицательные, что приводит к полярности молекулы SO2. Молекула имеет положительную область вблизи серы и отрицательные области около кислородных атомов.
Электронная формула SO2 помогает объяснить физические и химические свойства сернистого газа. Нелинейность молекулы создает возможность для различных взаимодействий и реакций, таких как образование соединений с другими элементами и проявление амфотерных свойств.
Причины нелинейности молекулы

Молекула сернистого газа (SO2) представляет собой нелинейную трехатомную молекулу. Нелинейность молекулы определяется несколькими факторами.
- Конфигурация электронных облаков: Молекула SO2 имеет две одинарные связи и одну двойную связь между атомами. Электронные облака, связанные с атомами серы и кислорода, отталкивают друг друга, создавая силу, которая смещает атомы и делает молекулу нелинейной.
- Электростатическое отталкивание электронных облаков: Поскольку электронные облака отрицательно заряжены, они отталкивают друг друга, что приводит к искривлению формы молекулы. Отталкивающие силы электронных облаков и связанные с ними изменения геометрии молекулы вносят вклад в ее нелинейность.
- Степень свободы молекулы: Молекула SO2 обладает двумя степенями свободы, что является одной из причин ее нелинейности. Свободное вращение молекулы вокруг оси и колебания атомов серы и кислорода в плоскости молекулы влияют на ее геометрию и компенсируют отталкивающие силы электронных облаков.
Все эти факторы в совокупности определяют нелинейность молекулы сернистого газа и имеют важное значение для его химических и физических свойств.
Структура сернистого газа
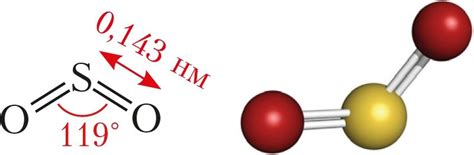
Молекулы сернистого газа обладают нелинейной структурой из-за расположения атомов в пространстве. Угловая форма молекулы соединения SO2 равна примерно 119,5°, что делает её нелинейной. Это означает, что молекула имеет несимметричное расположение своих атомов.
Нелинейность молекулы сернистого газа обуславливается электронной формулой SO2. Пары электронов, локализованных на атомах серы и кислорода, отталкиваются друг от друга, приводя к непарным электронным облакам. Это приводит к прогибу молекулы и нелинейности углов плоскости между атомами серы и кислорода.
Такая структура молекулы сернистого газа объясняет его химическую активность и способность выступать в реакциях, связанных с присоединением или отщеплением атомов. Нелинейность молекулярной структуры также влияет на физические свойства сернистого газа, такие как его растворимость, теплота испарения и плотность.
Взаимодействие электронов в молекуле сернистого газа
Молекула сернистого газа (SO2) состоит из атомов серы и кислорода, связанных с помощью соединительных ковалентных связей. Несмотря на простоту состава и структуры молекулы SO2, ее электронная формула оказывается нелинейной.
В молекуле SO2 у атома серы есть две электронные оболочки, включающие 16 электронов. Один электрон атома серы находится в s-орбитали, а остальные 15 электронов распределены между p-орбиталями. Атом кислорода имеет шесть электронов, распределенных между s- и p-орбиталями на двух электронных оболочках.
В процессе образования связей в молекуле SO2 происходит взаимодействие электронов атомов серы и кислорода. Трехцентровое взаимодействие формирует две связи S-O, и каждая связь занимает одну из трех p-орбиталей. Таким образом, электронная формула молекулы SO2 будет иметь вид O=S=O.
Эта нелинейная структура молекулы SO2 объясняет множество ее химических свойств. Нелинейность молекулы важна для объяснения симметрии, поляризуемости и других физических характеристик газа. Взаимодействие электронов в молекуле сернистого газа играет ключевую роль в определении его химических и физических свойств.
Двойная связь как причина нелинейности
Сернистый газ (SO2) представляет собой химическое соединение, состоящее из одного атома серы (S) и двух атомов кислорода (O).
В молекуле SO2 два атома кислорода связаны с серным атомом через две синглетные связи. Однако, эта структура не объясняет нелинейную формулировку молекулы.
Главная причина нелинейности молекулы SO2 заключается в наличии двойной связи между одним из кислородных атомов и серным атомом. Двойная связь представляет собой сильную химическую связь, которая имеет нелинейную форму.
Эта нелинейность проявляется в двух плоскостях: плоскости, содержащей серный атом и один из кислородных атомов, а также плоскости, которая проходит через серный атом и перпендикулярна первой плоскости.
Двойная связь между одним из атомов кислорода и серным атомом приводит к изменению геометрии молекулы и обусловливает нелинейный характер её формы. Это объясняется тем, что электронные облака двойной связи отталкивают электронные облака остальных атомов, вызывая отклонение от линейной конфигурации.
Именно трехатомная структура SO2 устанавливает его химические свойства и реактивность. Нелинейность этого соединения играет важную роль в его способности образовывать химические связи с другими веществами и участвовать в химических реакциях.
Электронное облако и поляризуемость молекулы сернистого газа
Молекула сернистого газа (SO2) состоит из одного атома серы и двух атомов кислорода. Обладая электронной структурой, эта молекула имеет электронное облако, которое состоит из общих внешних электронов этих атомов.
Молекулы сернистого газа обладают поляризуемостью, то есть способностью смещать свои электронные облака под действием внешнего электрического поля. Это происходит из-за асимметричной структуры молекулы и различного заряда атомов серы и кислорода.
Поле, создаваемое поляризованной молекулой сернистого газа, воздействует на другие молекулы рядом с ней и вызывает их поляризацию. Таким образом, молекулы сернистого газа взаимодействуют друг с другом и создают сложную сеть взаимодействий вещества.
Поляризуемость молекулы сернистого газа имеет прямое влияние на ее свойства и поведение. Нелинейность молекулы, вызванная поляризацией, определяет поперечные измерения молекулы и возможность взаимодействия с другими молекулами и веществами.
Понимание электронного облака и поляризуемости молекулы сернистого газа позволяет более точно описывать и моделировать ее свойства и реактивность. Это имеет важное значение для различных областей науки и технологии, таких как химия, физика и материаловедение.
Формирование химических связей в сернистом газе
Связи в сернистом газе образуются путем обмена электронами между атомами серы. Каждый атом серы имеет 6 электронов в валентной оболочке, но для полной насыщенности он нуждается еще в 2 электронах для формирования основной химической связи.
Молекула сернистого газа (SO2) состоит из одного атома серы и двух атомов кислорода. При образовании молекулы сернистого газа происходит обмен электронами между атомом серы и атомами кислорода. Атом серы отдает два электрона атомам кислорода, чтобы достичь полной насыщенности. В результате образуется две химические связи между атомом серы и каждым атомом кислорода.
Обмен электронами происходит благодаря различию электроотрицательности атома серы и атомов кислорода. Атомы серы имеют меньшую электроотрицательность, чем атомы кислорода, и поэтому готовы отдать свои электроны для создания связи. Атомы кислорода, в свою очередь, имеют большую электроотрицательность, что позволяет им принимать электроны и образовывать связь с атомом серы.
Образование химической связи в сернистом газе ведет к стабилизации молекулы и образованию ковалентной связи между атомами. Эта связь обладает определенной прочностью и устойчивостью, что позволяет молекуле сохранять свою структуру и участвовать в химических реакциях.
Физические свойства сернистого газа и его применение

Сернистый газ (диоксид серы, SO2) представляет собой химическое соединение серы и кислорода. Он обладает рядом уникальных физических свойств, которые находят применение в различных областях человеческой деятельности.
Физические свойства:
1. Цвет и запах: Сернистый газ является бесцветным и не имеет запаха. Это делает его трудно обнаружимым без специальных инструментов.
2. Растворимость в воде: SO2 хорошо растворяется в воде и образует сульфиты, что делает его важным реагентом в химической промышленности.
3. Токсичность: Сернистый газ является токсичным веществом, вдыхание которого может вызвать серьезные проблемы со здоровьем человека.
Применение:
1. Производство сернистой кислоты: SO2 является основным сырьем для производства сернистой кислоты (H2SO3), которая широко применяется в производстве удобрений, текстильной промышленности и металлургии.
2. Пищевая промышленность: Сернистый газ используется в пищевой промышленности для консервирования пищевых продуктов и предотвращения окисления и разрушения пищевых качеств.
3. Защита растений: SO2 применяется для защиты растений от вредителей и болезней, так как он обладает антисептическими свойствами и способен уничтожать патогенные микроорганизмы.
4. Промышленная очистка: Сернистый газ используется в различных процессах промышленной очистки, таких как удаление вредных газов и снижение выбросов в атмосферу.
5. Производство бумаги и картонных упаковок: SO2 используется для отбеливания целлюлозы в процессе производства бумаги и картонных упаковок.



